La acondroplasia es el tipo más común de displasia esquelética y supone casi el 90% de casos de baja estatura desproporcionada o enanismo. Está causada por una mutación de ganancia de función en el gen del receptor 3 del factor de crecimiento de fibroblastos (FGFR3), se caracteriza por un retraso en el crecimiento óseo endocondral y posee unas características físicas distintivas:1,3-8
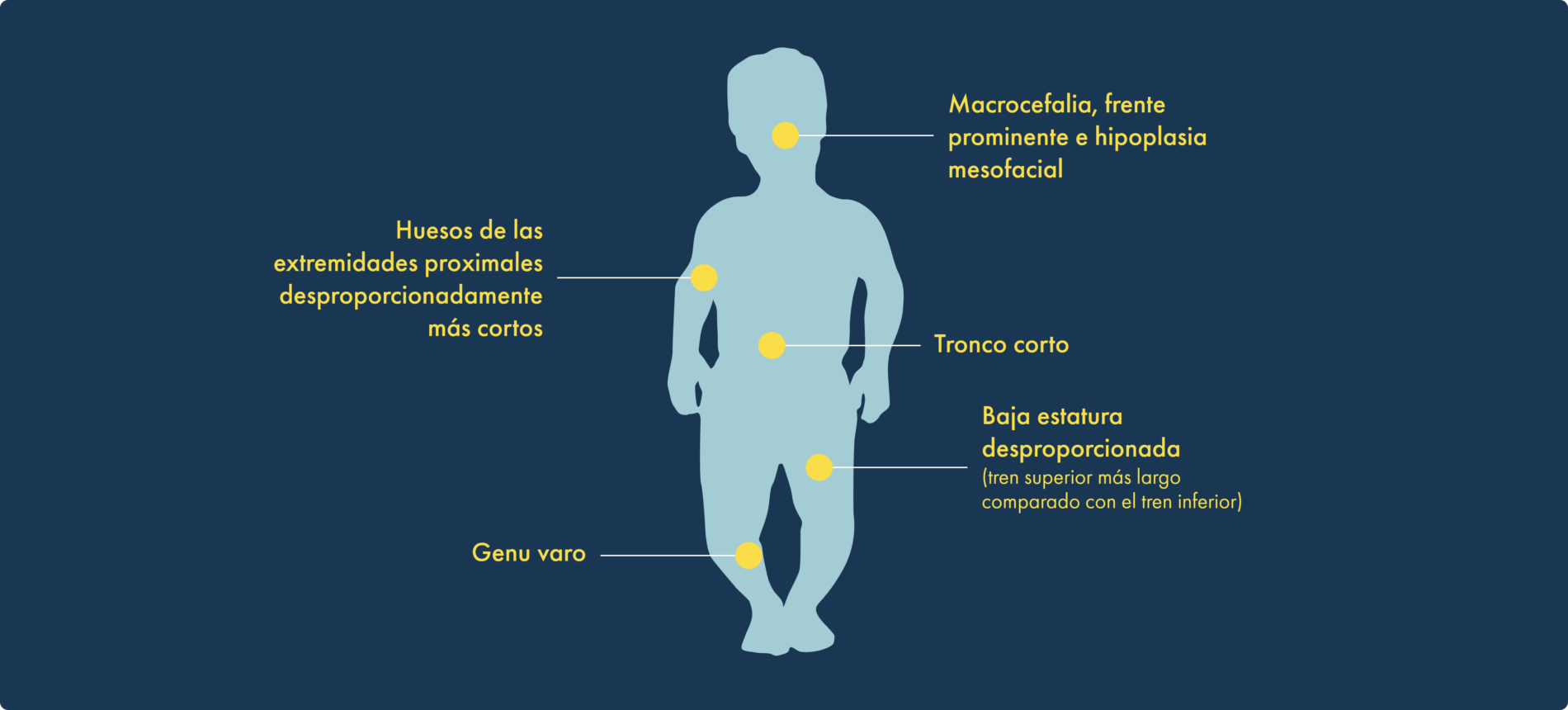
Ciertas características físicas, como la altura, son indicadores del crecimiento óseo en el cuerpo
La osificación endocondral (la sustitución de cartílago por hueso) tiene lugar en todo el cuerpo e interviene en el desarrollo de aproximadamente el 90% de los huesos. Este proceso se inicia en el útero y continua hasta el inicio de la edad adulta.10-12
En la osificación endocondral, el precursor del futuro hueso es el cartílago




La mutación de ganancia de función hace que el FGFR3 genere señales de forma excesiva para ralentizar el crecimiento óseo, de manera que supera la señalización opuesta de la vía del NPR-B/CNP y provoca un retraso en el crecimiento óseo.4,16

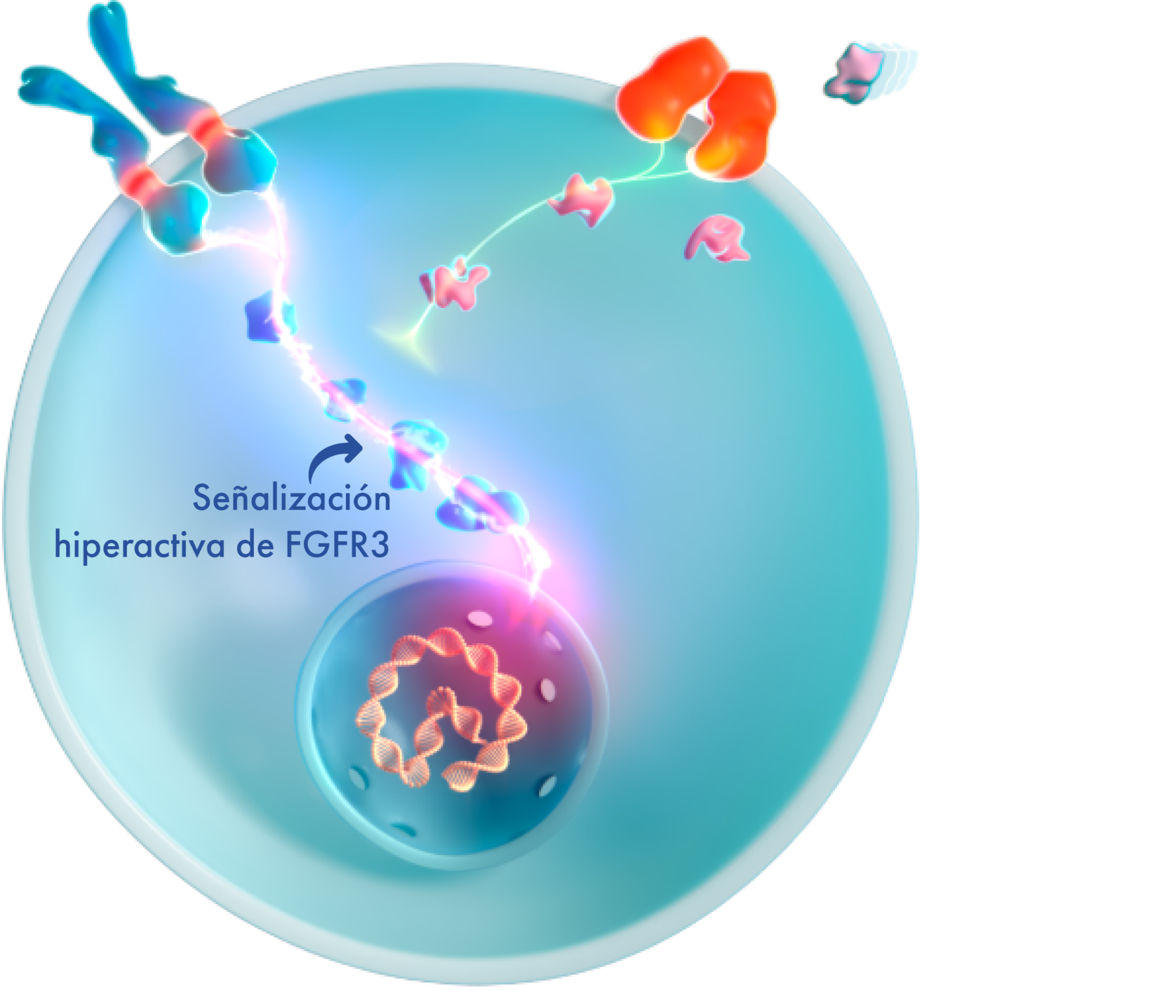

Esto tiene un efecto multisistémico para el que los padres pueden no estar preparados
La acondroplasia ocurre en aproximadamente _________ nacidos vivos en todo el mundo.

Se pueden esperar complicaciones comunes de la acondroplasia a lo largo de la vida de un individuo.

Todo lo que necesitas para profundizar en tus conocimientos sobre la acondroplasia