Die meisten Eltern haben eine durchschnittliche Statur. Das heißt, sie sind auf Ihr Fachwissen angewiesen, um sich auf die multisystemischen Komplikationen eines gestörten Knochenwachstums einzustellen.4,17
Achondroplasie tritt bei 1 von 25.000 Lebendgeburten auf; weltweit sind rund 250.000 Menschen betroffen1,2 Bei nahezu 90 % der Personen mit dysproportioniertem Kleinwuchs ist diese Krankheit die Ursache. Kennzeichnend ist ein gestörtes enchondrales Knochenwachstum. Dies wird durch eine Gain-of-Function-Mutation im Gen für den Fibroblasten-Wachstumsfaktor-Rezeptor 3 (FGFR3) hervorgerufen. Die Betroffenen weisen charakteristische körperliche Merkmale auf1,3-8
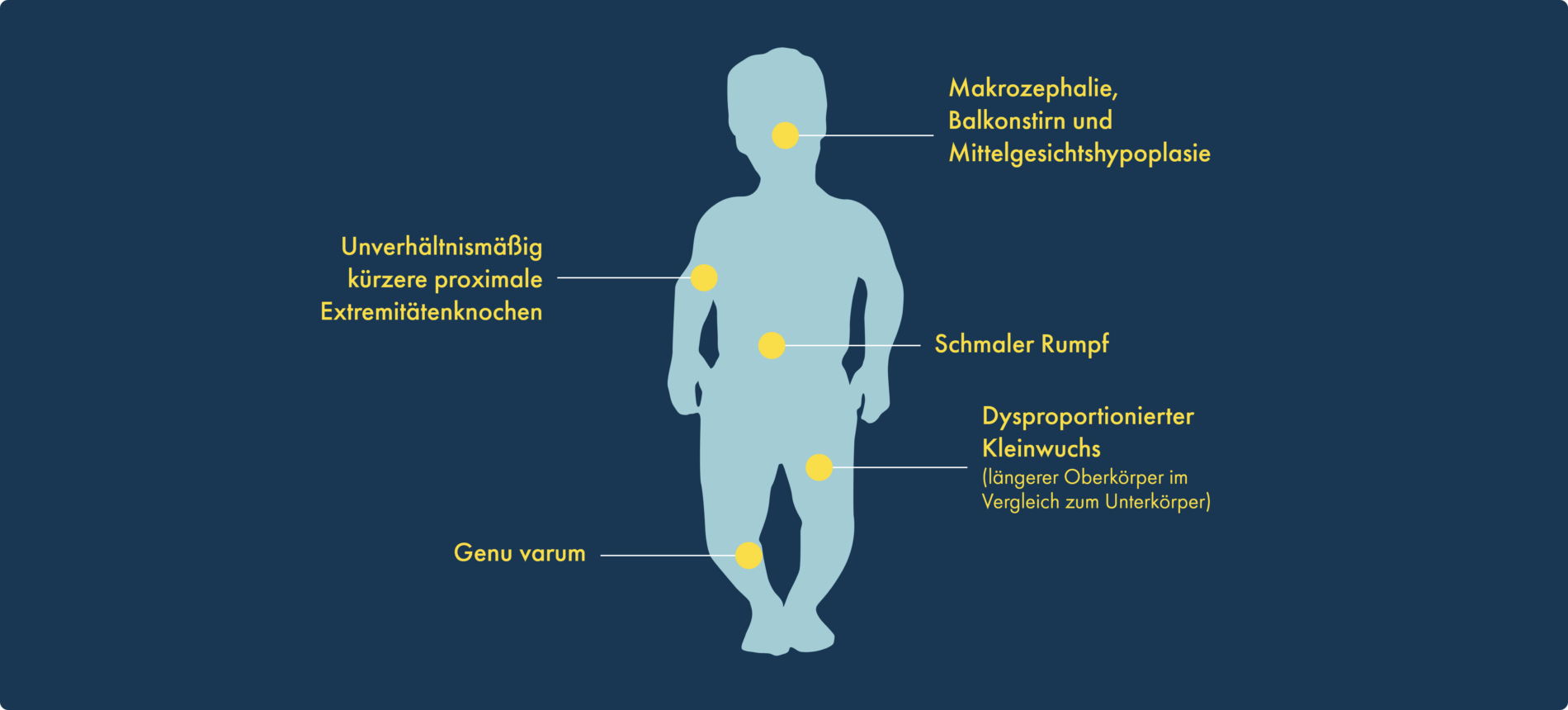
Äußerliche Merkmale wie die Körpergröße sind ein Indikator für das Knochenwachstum im ganzen Körper
Die enchondrale Ossifikation, findet überall im Körper statt. Bei der Entwicklung von ungefähr 90 % aller Knochen spielt dieser Prozess eine Rolle. Die Ossifikation beginnt bereits im Mutterleib und dauert bis in das frühe Erwachsenenalter an.10-12
Bei der enchondralen Ossifikation stellt Knorpel den Vorläufer des zukünftigen Knochens dar




Aufgrund der Gain-of-Function-Mutation erzeugt der FGFR3-Rezeptor kontinuierlich Signale zur Verlangsamung des Knochenwachstums, die stärker sind als die entgegenwirkenden Signale des NPR-B/CNP-Signalwegs. Die Folge ist ein gestörtes Knochenwachstum.4,16

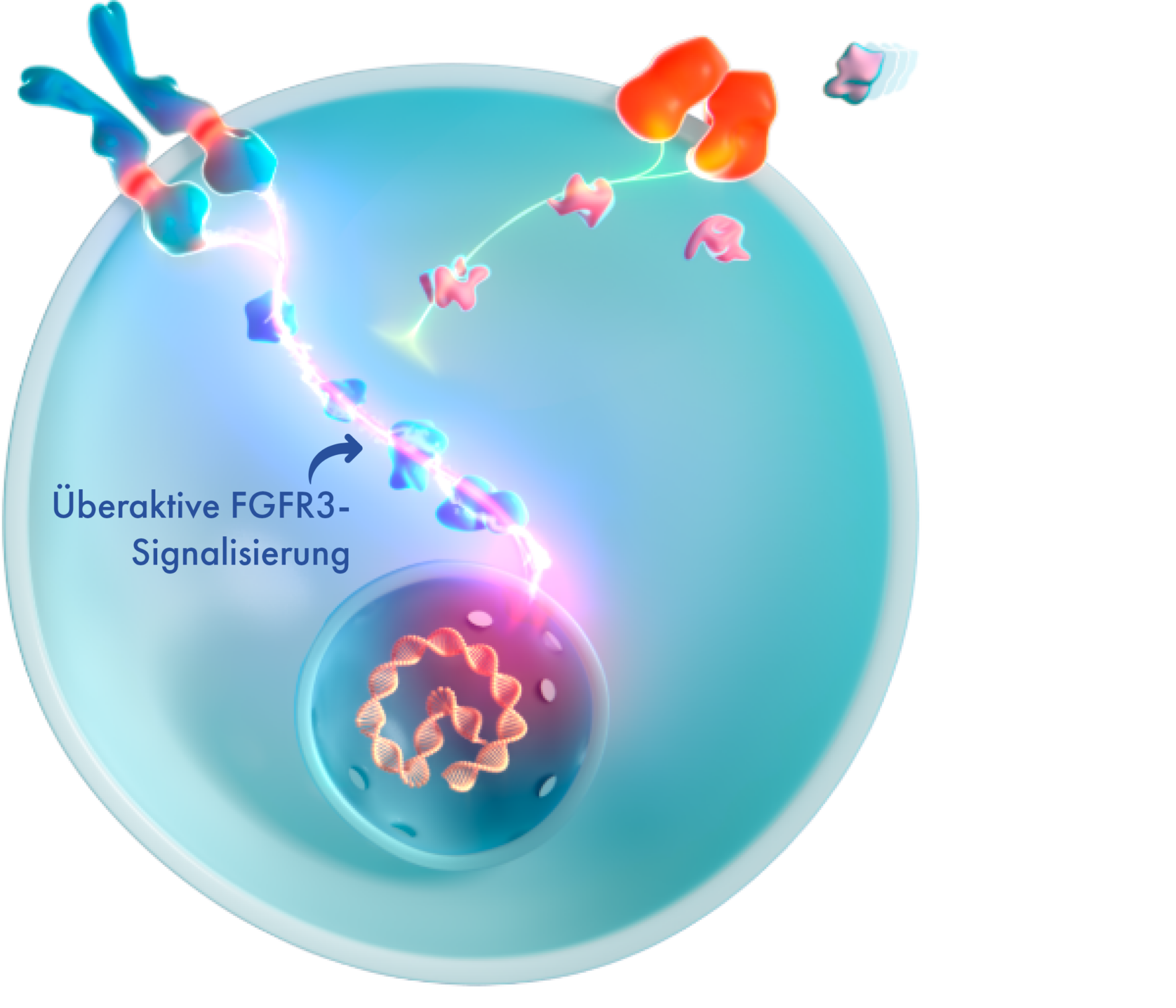

Dies hat multisystemische auswirkungen, auf die eltern möglicherweise nicht vorbereitet sind
Die meisten Eltern haben eine durchschnittliche Statur. Das heißt, sie sind auf Ihr Fachwissen angewiesen, um sich auf die multisystemischen Komplikationen eines gestörten Knochenwachstums einzustellen.4,17
Achondroplasie tritt weltweit bei etwa _________ Lebendgeburten auf.

Im Laufe des Lebens ist mit häufigen Achondroplasie-Komplikationen zu rechnen.

Alles, was Sie brauchen, um Ihr Wissen über Achondroplasie zu vertiefen